2018年8月9日,《Cell》杂志发表了许瑞明课题组与美国哥伦比亚大学张志国课题组合作完成的研究论文“Multisite substrate recognition in Asf1-dependent acetylation of histone H3K56 by Rtt109”。该工作通过解析真菌特有的组蛋白乙酰转移酶Rtt109与活性调节因子Asf1以及底物H3-H4复合物的晶体结构,并结合大量的生化和遗传学实验,首次揭示了组蛋白伴侣调节组蛋白修饰酶活性的分子机理。这也是染色质领域第一个组蛋白修饰酶与完整底物复合体的结构。
核小体是真核生物染色质的基本结构单元,是由约146bp的DNA缠绕在核心组蛋白八聚体而形成的。染色质局部结构的动态变化影响着许多重要的生命活动过程,如DNA复制、RNA转录、DNA损伤修复、重组等。组蛋白翻译后修饰是影响染色质结构的重要因素,这些修饰主要发生在组蛋白末端的尾巴上,包括甲基化、乙酰化、磷酸化和泛素化等修饰。
2007年张志国和许瑞明课题组合作报道了组蛋白H3K56位乙酰化现象,并鉴定出真菌特有的乙酰转移酶Rtt109是催化该修饰的酶(Han et al., Science 2007)。这与之前发现的所有位于组蛋白N-端无规则尾巴的位点都不同,H3K56位于H3的N端α-螺旋结构域内,靠近核小体DNA的进出口。缺少H3K56乙酰化修饰的细胞易发生DNA损伤及染色质重排,认为这与该修饰在DNA复制叉的稳定及核小体成熟中发挥的作用密切相关。更为有意思的是,张志国和许瑞明课题组进一步研究了两种组蛋白伴侣Asf1和Vps75对Rtt109酶活性的调节作用(Han et al., JBC 2007a, 2007b),体外实验表明两种组蛋白伴侣均可与Rtt109形成复合体,但Vps75主要促进了Rtt109在H3K9和H3K27位点的催化活性,而Asf1是促进H3K56位乙酰化的重要调节因子。
由于Rtt109和Asf1体外复合体的组装存在一定的困难,并且如何排除Vps75的干扰也需要很多的尝试。该项工作中,许瑞明和张志国课题组经过了十余年的努力,巧妙地通过采用缺少Vps75结合部位的烟曲霉的Rtt109,与酵母Asf1和底物组蛋白H3-H4组装了很好的复合体,并成功地解析了该四元复合物与乙酰基供体CoA复合物的晶体结构。从结构中可以看到,H3K56所在的N端α-螺旋被打开,形成一段柔性的loop区,该loop区结合在Rtt109的活性口袋周围,从而使H3K56的侧链伸入活性口袋。有意思的是,尽管组蛋白伴侣Asf1对于H3K56修饰必不可少,但是Asf1与Rtt109之间并没有直接的相互作用。Asf1通过其C端的一个β-strand与组蛋白H4的C端之间形成β-折叠片,稳定了H4末端的一个关键片段,使得底物处于更利于催化的构象进而促进Rtt109的活性。这个结构特性也被进一步的生化和遗传学实验确证是Rtt109发挥功能的必要条件;另外,Rtt109与组蛋白H3的核心螺旋结构的相互作用也是其活性所必需的。这项工作首次揭示了组蛋白修饰酶的多亚基、多底物识别位点的复杂调控机制,为我们理解该类乙酰化酶的底物识别和活性调控机制提供了重要的基础,也为以Rtt109为靶点的抗真菌药物研究提供了线索和依据。
该工作由中国科学院生物物理研究所许瑞明课题组与美国哥伦比亚大学张志国课题组合作完成。许瑞明研究员和张志国教授为本文的共同通讯作者,许瑞明课题组博士生张林和张志国课题组的Serra-Cardona Albert为本文的共同第一作者。上海光源在晶体衍射数据收集过程中给予了大力支持。该工作也得到了国家自然科学基金创新群体、重大国际合作项目(许瑞明与张志国合作申请),国家973计划、重点研发计划,中科院B类先导计划和北京市自然科学基金的资助。
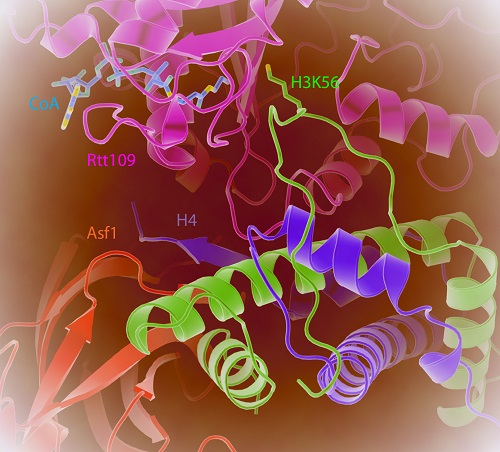
图注:Rtt109-Asf1-H3-H4四元复合物和酰基供体乙酰辅酶A复合体的晶体结构。H3的N端α-螺旋被打开,形成一段柔性的loop区;Asf1并不与Rtt109直接相互作用,而是通过其C端的一个β-strand与组蛋白H4的C端之间形成β-折叠片,稳定了H4末端的一个关键片段,使得底物处于更利于催化的构象进而促进Rtt109的活性。
文章链接:https://www.cell.com/cell/fulltext/S0092-8674(18)30899-7
供稿:许瑞明课题组