2018年12月14日,Nature Communications杂志在线发表了中国科学院生物物理研究所章新政课题组与中国农业科学院哈尔滨兽医研究所王靖飞课题组合作完成的研究论文Implication for alphavirus host-cell entry and assembly indicated by a 3.5 angstrom resolution cryo-EM structure。该课题利用章新政课题组发展的分块重构算法(zhuet al.,Nat. Commun., 2018)克服了病毒结构的柔性问题,将辛得毕斯病毒的结构推到了3.5 埃,获得了甲病毒家族的第一个准原子分辨率结构。基于保守氨基酸侧链之间相互作用,该结构清晰的阐述了该病毒的组装机制,并在病毒包膜附近发现了一个由未知的外源小分子稳定的疏水口袋,该口袋在病毒的组装和入侵时均起到重要作用。甲病毒属于披膜病毒科,其中包含了对人类具有致死性的病毒,几种常见的病毒例如SINV,SFV,CHIV,VEEV在世界范围内分布广泛,但是目前为止还没有针对性的药物或疫苗。
甲病毒表面有80个三聚体形式的刺突蛋白,每个三聚体包含三个E1/E2组成的二聚体。E2蛋白负责细胞受体的识别,由A、B、C三个胞外域与位于细胞膜附近的D结构域共同组成;E1蛋白负责病毒的膜融合,包含DI, DII and DIII三个胞外域,其中参与融膜的肽段位于DII结构域的远端。E1-E2二聚体的胞外域结构在中性及酸性pH条件下已经有了较高分辨率的晶体结构,但是该病毒的完整结构在冷冻电镜领域最高分辨率仅4.8 埃。受到分辨率的限制,E2蛋白D结构域附近的E1-E2相互作用以及相邻三聚体之间E2间的相互作用都无法得到清晰的阐述。
该研究解析了3.5 埃的辛得毕斯病冷冻电镜结构,使完整糖蛋白结构中氨基酸侧链之间的相互作用清晰可见,揭示了β-ribbon connector与E3、B结构域之间的相互作用,这对于病毒在酸性pH下的构象变化具有重要意义;我们还发现了两种类型的三聚体刺突蛋白之间的相互作用,经过分析发现了8对氨基酸是完全保守或高度保守的,这些相互作用对病毒的组装直接相关;此外,该研究还发现了由E2蛋白的D结构域及E1、E2的跨膜螺旋共同构成的疏水口袋结构,该口袋结构由大量完全保守和高度保守的氨基酸组成,口袋中的磷脂状尾巴小分子与周围的保守氨基酸具有疏水相互作用,稳定了该口袋结构。通过结构分析,以及其他甲病毒结构、功能数据分析,该疏水口袋的稳定性和病毒入侵以及组装密切相关。同时,我们的更多工作(未发表)显示,该结构在甲病毒家族中非常保守。因此,该结构特征可能是甲病毒家族的一个重要药物靶点。
中国科学院生物物理研究所章新政研究员及中国农业科学院哈尔滨兽医研究所王靖飞研究员为本文的通讯作者,章新政组的博士生陈利红、朱东杰及王靖飞组的王铭、孙振钊为本课题的并列第一作者。本项目得到中国科学院战略性先导科技专项(B类)、科技部重点研发计划以及中组部青年千人项目、国家自然科学基金的支持。
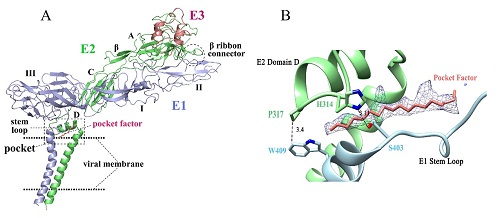
A. E1、E2、E3的原子模型,包括E1的I,II ,III结构域,E2的A,B,C结构域及D亚基,E1、E2的跨膜螺旋
B. 疏水口袋中的磷脂状尾巴结构及疏水口袋中具有相互作用的完全保守氨基酸。
文章链接:https://www.nature.com/articles/s41467-018-07704-x
供稿:章新政课题组